[fusion_builder_container hundred_percent=”no” equal_height_columns=”no” menu_anchor=”” hide_on_mobile=”small-visibility,medium-visibility,large-visibility” class=”” id=”” background_color=”” background_image=”” background_position=”center center” background_repeat=”no-repeat” fade=”no” background_parallax=”none” parallax_speed=”0.3″ video_mp4=”” video_webm=”” video_ogv=”” video_url=”” video_aspect_ratio=”16:9″ video_loop=”yes” video_mute=”yes” overlay_color=”” video_preview_image=”” border_size=”” border_color=”” border_style=”solid” padding_top=”” padding_bottom=”” padding_left=”” padding_right=””][fusion_builder_row][fusion_builder_column type=”1_1″ layout=”1_1″ background_position=”left top” background_color=”” border_size=”” border_color=”” border_style=”solid” border_position=”all” spacing=”yes” background_image=”” background_repeat=”no-repeat” padding=”” margin_top=”0px” margin_bottom=”0px” class=”” id=”” animation_type=”” animation_speed=”0.3″ animation_direction=”left” hide_on_mobile=”small-visibility,medium-visibility,large-visibility” center_content=”no” last=”no” min_height=”” hover_type=”none” link=””][fusion_text]
乐诚铎(Franck Le Deu)
麦肯锡全球资深董事合伙人
近日,我参加了于上海举行的第四届BioCentury中国医疗健康峰会。此次峰会由BioCentury和百华协会(BayHelix)主办,麦肯锡为合作伙伴。在生物制药领域,这个峰会现在几乎已是私募股权/风险投资、研发、本土生物技术公司,以及跨国药企高管层必定出席的年度盛会。
这次峰会洋溢着“高歌猛进”的气氛,大家都很乐观。我觉得这主要归功于以下几个重大利好:
- 国务院再次要求全国各地区各部门贯彻落实《“健康中国2030”规划纲要》;
- 国家食品药品监督管理总局药品审评审批制度改革取得突破性进展;
- 几家中国生物科技公司(如再鼎医药、药明生物)成功上市;
- 政策层面对新药回报的支持(尤其是国家医保目录的更新和国家药品价格谈判);
- 2017年生物制药行业增长强劲,增速重回两位数;
- 一系列创新药物将在未来几年内上市,有些已在美国和欧盟市场取得成功。
当然,乐观往往伴随着审慎,而且在中国,对未来展望保持适度平衡也是重要的。在医保系统成本可控的前提下,若要让更多人更快受惠于创新药,还有大量的工作要做。
下面我谈一谈我对现有成果与未来挑战的理解。
首先,创新药的推广需要两方面齐头并进。一方面,需要一个支持创新药物审评审批的生态系统,并保证其时限与监管要求与美国食品和药物管理局和欧盟的欧洲药品管理局适用的国际标准相符;另一方面,也是同样重要的,定价与医保体系要能平衡制药企业与投资者之间的利益关系,在保证创新的投资回报的同时,兼顾到不同收入水平人群的大量的迫切需求。
接下来,我将进一步对这两个方面展开论述。
1)创新生态系统——改革的“速度与激情”
自2015年末以来,中国国家食品药品监督管理总局的改革快马加鞭,辐射全国各个行业。从机制上看,启动了优先审批程序,药品审评中心(CDE)审核人员也从200人增至600人,中国于今年6月获准加入了人用药品注册技术国际协调会议(ICH)。这意味着生物制药与监管机构之间的对话机制已发生转变。这种对话是建设性的,是建立在切实解决共同问题基础之上的。
这样的进步可喜可贺,但前路漫漫未来可期。我们相信,改革在过去几年中已经解决了一些重大问题,现在正进入第二个关键阶段,将为中国与国际创新接轨铺平道路。

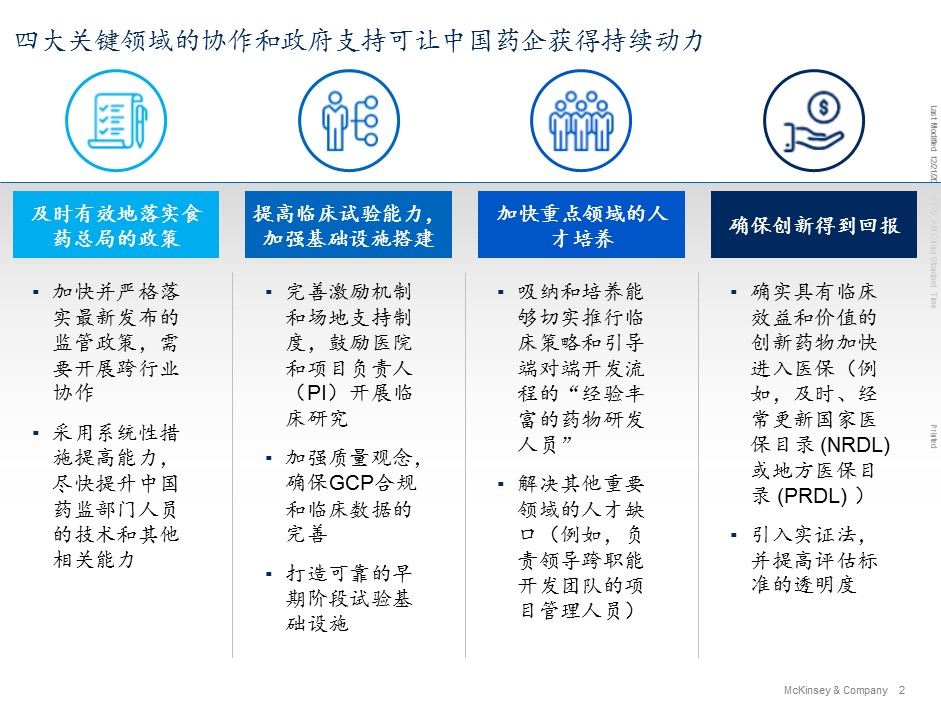
在这个新的阶段(如早期试验、专利链接、橙皮书、罕见病患者登记制度等),我们需要在多个维度上集中发力。具体而言,可从以下四个领域采取行动以推动改革更进一步:
1) 及时、有效地落实国家食品药品监督管理总局的政策;
2) 提高临床试验的能力,加强与之相关的基础设施搭建;
3) 加快重点领域的人才培养;
4) 确保创新得到回报。
2)定价与医保——发展势头向好
过去几年的进展不算显著,但应关注以下积极动态。
- 全国医保目录的更新。这是自2009年以来一直被业界所期盼的。上个十年中上市的重要药物将受益于新的医保目录。跨国药企是最大的受益者,有70多种药物进入新目录。
- 建立国家药品价格谈判与医保准入机制。政府已与厂商开展谈判,旨在为昂贵的重大疾病,尤其是癌症制定新的国家定价机制。44种药品列入医保谈判范围,主要来自跨国药企,其中36种谈判成功,平均价格降幅达到45%。
- 医保目录的动态调整。在不久的将来,任何新上市的药物都有可能在推出两年内申请进入医保目录。
- 创新药专项支付机制。针对创新药的一些支付机制,将使创新药的使用不再受制于医院药品收入的预算上限。
- 商业健康险扩张,创新模式涌现。例如,近期泰康和腾讯基于战略合作推出的微医保。
与此同时,几大主要挑战仍然存在,可能对有需求的患者使用新药会造成影响。
1.知识产权保护:在保护和支持专利上,中国已取得长足的进步。但丙肝药物在中国市场的发展现状值得思考。虽然2017年多家跨国药企的多个重要丙肝治疗方案获批。但鉴于疾病的严重性,以及药品国内上市严重滞后于国外上市时间,再加上昂贵的治疗成本,许多中国患者远赴印度寻求治疗。因为在印度,可以买到价格低很多的仿制药。从知识产权的角度来看,这其实更令人担心。因为印度的仿制药已进入中国市场治疗为数众多的丙肝患者。若其他疾病类别的治疗加以效仿,跨国药企可能会调高对中国的风险预期。
2.优化医保报销流程:药品加入医保目录是重大的一步,但若要患者切身受益,该目录在地方各省也应得到贯彻落实。不过,地方上的落实速度快慢不一,对药厂的要求也不同。所以在实际操作时,目录的落实,以及市场覆盖的扩大与医保情况的对接往往会耗时数年。
3.调整市场覆盖以及产品上市模式,以挖掘定价/销量的弹性潜力:鉴于大多数治疗方案的患者渗透率很低,药价降低40-60%,制药公司的销量有望反弹。这就需要制药公司有能力触达那些“有支付能力”的新患者,尤其是在低线城市。此外,提高市场覆盖率会增加成本,若对成本有顾虑,则可能会让扩大市场渗透的计划搁浅,从而降低了药物的可及性。
4.大量新药争夺稀缺资源。医保目录的更新使得许多药品被“重新上市”,再加上未来数年陆续有新药推出,我们估计,在短时间内将有超过200种创新药物面市。这将对医疗体系形成方方面面的压力:药物临床试验机构、国家医保基金资源、制定创造性上市策略的人才、医院进药,以及显而易见的,关键意见领袖。
对于中国的生物制药创新和患者而言,2017无疑是具有里程碑意义的一年。未来的3-5年将决定中国能否成为生物制药的创新重地,否则或将错失机遇。
作者:
乐诚铎是麦肯锡全球资深董事合伙人,大中华区医疗保健咨询业务负责人。过去的12年主要在上海和香港工作。
点击此处前往乐诚铎的领英页面